Wer persönliche Schutzausrüstung (PSA) auf den Markt bringen will, muss andere Gesetze beachten als jemand, der Medizinprodukte (MP) in den Verkehr bringt. Daher ist es wichtig, die jeweils anwendbaren Regularien zu identifizieren und zu befolgen.
Dieser Beitrag erläutert, wie persönliche Schutzausrüstung und Medizinprodukte voneinander abgegrenzt werden. Er stellt die Regularien und den Weg vor, um persönliche Schutzausrüstung schnell und gesetzeskonform herzustellen und zu vermarkten. So lassen sich rechtliche Risiken und unnötige Aufwände vermeiden
1. Persönliche Schutzausrüstung (PSA) versus Medizinprodukt
a) Die Zweckbestimmung entscheidet
Ob ein Produkt als persönliche Schutzausrüstung zählt, hängt von der Zweckbestimmung dieses Produkts ab:
- Dient das Produkt ausschließlich dem Schutz des Anwenders (d.h. der tragenden Person) gegen ein oder mehrere Risiken für seine Gesundheit oder Sicherheit, ist das Produkt der persönlichen Schutzausrüstung zuzuordnen.
- Sobald das Produkt einen Patienten schützen soll, ist das Produkt ein Medizinprodukt.
Wenn ein Produkt beiden Zweckbestimmungen dient, ist es sowohl ein Medizinprodukt als auch eine persönliche Schutzausrüstung.
b) Beispiele
Die in der folgenden Tabelle aufgeführten Beispiele zeigen, wie die Zweckbestimmung darüber entscheidet, ob ein Produkt als Medizinprodukt oder als persönliche Schutzausrüstung (oder beides) zu qualifizieren ist.
| Produkt | Medizinprodukt | Persönliche Schutzausrüstung |
|---|---|---|
| Handschuhe | OP-Handschuhe, Untersuchungshandschuhe | Schutzhandschuhe (z.B. Gebrauch in medizinischen Laboren) |
| Bekleidung | OP-Bekleidung (Kittel und Kopfbedeckung), Strahlenschutzkleidung (bspw. Gonadenschutz) für Patienten | Strahlenschutzbekleidung für Anwender |
| Mundschutz | Mundschutz mit medizinischem Zweck | Zahnschutz für Boxer |
| Masken | Atemschutzmasken mit medizinischem Zweck | Staubschutzmasken |
| Brillen | Korrigierende Brillen (auch mit Lichtschutz) | Sonnenbrillen, Augenschutzbrillen (auch mit angepassten Gläsern), Schutzbrillen im beruflichem Umfeld (z.B. Schweißerbrillen) |
| Laserbrillen | Laserschutzbrille für Patienten | Laserschutzbrille für Anwender |
| Bandagen | Therapeutische Bandagen | Sportbandagen zur Prävention |
| Helme | Schutzhelm für Kraniektomie, Epilespiehelm | Fahrradhelm, Motorradhelm, Sporthelm |
Die Einteilung erfolgt nicht auf Basis der Funktionalität bzw. nach Art des Produkts, sondern auf Basis des vorgesehenen Anwendungszwecks!
c) Definitionen
Die Verordnung (EU) 2016/425 („PSA-Verordnung“) definiert „persönliche Schutzausrüstung“ wie folgt:
„a) Ausrüstung, die entworfen und hergestellt wird, um von einer Person als Schutz gegen ein oder mehrere Risiken für ihre Gesundheit oder ihre Sicherheit getragen oder gehalten zu werden,
EU-Verordnung 2016/425 Artikel 3
b) austauschbare Bestandteile für Ausrüstungen gemäß Buchstabe a, die für ihre Schutzfunktion unerlässlich sind,
c) Verbindungssysteme für Ausrüstungen gemäß Buchstabe a, die nicht von einer Person gehalten oder getragen werden und so entworfen sind, dass sie diese Ausrüstung mit einer externen Vorrichtung oder einem sicheren Ankerpunkt verbinden, und die nicht so entworfen sind, dass sie ständig befestigt sein müssen, und die vor ihrer Verwendung keine Befestigungsarbeiten benötigen;“
2. Regulatorische Anforderungen an persönliche Schutzausrüstung (PSA)
a) Die Verordnung 2016/425 im Überblick
Hersteller von persönlicher Schutzausrüstung müssen die Verordnung (EU) 2016/425 über persönliche Schutzausrüstung befolgen. Diese Verordnung löste 2016 die bis dato geltende Richtlinie 89/686/EWG ab.
Diese „PSA-Verordnung“ ist mit 82 Seiten im Vergleich zur MDR (263 Seiten) kurz. Beide Verordnungen nutzen vergleichbare Konzepte:
- Hersteller müssen ein Konformitätsbewertungsverfahren durchlaufen, um die Konformität der Produkte nachzuweisen.
- Die Wahl des Konformitätsbewertungsverfahrens hängt vom Produkt ab. Ähnlich der Klassifizierung bestimmt die Kategorie des Produkts die möglichen Verfahren.
- Beide Verordnungen legen Anforderungen an die Produkte fest, die bei der PSA-Verordnung „Gesundheitsschutz- und Sicherheitsanforderungen“ heißen und bei der MDR „Grundlegende Sicherheits- und Leistungsanforderungen“.
b) Anforderungen an Produkte, die sowohl PSA als auch Medizinprodukte sind
Bis 2007 war ein Produkt entweder ein Medizinprodukt oder eine persönliche Schutzausrüstung. Anschließend wurde ein Passus in die Medizinprodukterichtlinie (MDD) aufgenommen, welcher den Nachweis der grundlegenden Gesundheits- und Sicherheitsanforderungen der PSA-Verordnung verlangte. Seit die PSA-Verordnung sowie die MDR gilt, ist eine gleichzeitige Einstufung als Medizinprodukt und als persönliche Schutzausrüstung möglich.
Für eine Schutzausrüstung, die auch ein Medizinprodukt ist, müssen Hersteller somit auch die die Medizinprodukteverordnung befolgen und umgekehrt.
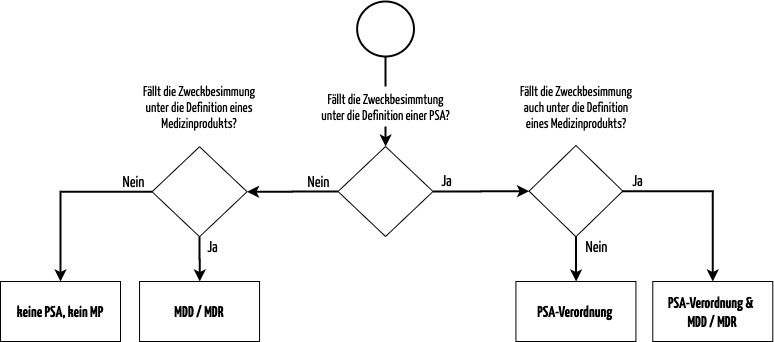
Das folgende Flowchart hilft, die anwendbaren Regularien zu identifizieren:
c) Normen
Um die Konformität mit den gesetzlichen Anforderungen nachzuweisen, können Hersteller produktspezifische harmonisierte Normen heranziehen. Die Einhaltung dieser Normen ist jedoch nicht verbindlich, sofern die konkreten Gesundheitsschutz- und Sicherheitsanforderungen erfüllt werden. Das Johner Institut empfiehlt deren Anwendung.
Falls Hersteller Normen verwenden, sollten sie die jeweils aktuellen Versionen und deren Anhänge nutzen.
Die folgende Tabelle liefert eine Übersicht über die Einordnung verschiedener Produkte und die jeweils anzuwendenden Regularien und Normen.
| Produkt | Einordnung | Klasse / Kategorie | Normen, Standards |
|---|---|---|---|
| Schutzbrillen | Verordnung (EU) 2016/425 (PSA) | min. Kategorie II ¹ | EN 166, ANSI/ISEA Z87.1 oder vergleichbare |
| Visiermaske (Vollgesichtsmaske) | Verordnung (EU) 2016/425 (PSA) | min. Kategorie II ¹ | EN 166, ANSI/ISEA Z87.1 oder vergleichbare |
| Partikelfiltrierende Halbmasken (bspw. FFP2- und FFP3-Masken) | Verordnung (EU) 2016/425 (PSA) | Kategorie III | EN 149 oder vorübergehend vergleichbare Standards wie NIOSH N95 (USA), KN95 (CHN), P2(AUS/NZL), DS (JPN), 1st Class (KOR) |
| Mund-Nasen-Schutz (MNS) | Richtlinie (EU) 93/42/EWG oder Verordnung (EU) 2017/745 (Medizinprodukt) | Klasse I | EN 14683 oder vorübergehend vergleichbare Standards wie ASTM |
| Operationskleidung | Richtlinie (EU) 93/42/EWG oder Verordnung (EU) 2017/745 (Medizinprodukt) | Klasse I | EN 13795, AAMI PB70 oder gleichwertige Normen |
| Schutzkleidung | Verordnung (EU) 2016/425 (PSA) | Kategorie III | EN 13795, EN 14605, AAMI PB70 oder gleichwertige Normen |
| Einmalhandschuhe | Verordnung (EU) 2016/425 (PSA) oder (als Adjunktion) Richtlinie (EU) 93/42/EWG oder Verordnung (EU) 2017/745 (Medizinprodukt), abhängig von der Zweckbestimmung | Klasse I oder min. Kategorie II ¹ | EN 374, EN 420, EN 455 |
d) Technische Dokumentation
Hersteller bzw. Inverkehrbringer von persönlicher Schutzausrüstung (PSA) müssen eine technische Dokumentation erstellen, wie sie die Verordnung 2016/425 im Anhang III beschreibt. Die Verordnung verpflichtet die Hersteller zumindest das Folgende zu dokumentieren:
- eine vollständige Beschreibung der PSA und ihrer bestimmungsgemäßen Verwendung;
- eine Beurteilung der Risiken, vor dem/denen die PSA schützen soll;
- eine Liste der grundlegenden Gesundheitsschutz- und Sicherheitsanforderungen, die auf die PSA anwendbar sind;
- Entwurfs- und Fertigungszeichnungen sowie entsprechende Pläne der PSA, ihrer Bauteile, Baugruppen und Schaltkreise;
- Beschreibungen und Erläuterungen, die zum Verständnis der Zeichnungen und Pläne gemäß Buchstabe d sowie der Funktionsweise der PSA erforderlich sind;
- die Fundstellen der harmonisierten Normen gemäß Artikel 14, die bei Entwurf und Herstellung der PSA angewandt wurde(n). Im Fall von teilweise angewandten harmonisierten Normen werden die Teile, die angewandt wurden, in den Unterlagen angegeben;
- wurden harmonisierte Normen nicht oder nur teilweise angewandt, Beschreibungen der sonstigen technischen Spezifikationen, die angewandt wurden, um die anwendbaren grundlegenden Gesundheitsschutz- und Sicherheitsanforderungen zu erfüllen;
- die Ergebnisse der Entwurfsberechnungen, Inspektionen und Untersuchungen zur Überprüfung der Konformität der PSA mit den anwendbaren grundlegenden Gesundheitsschutz- und Sicherheitsanforderungen;
- Berichte über die durchgeführten Prüfungen zur Überprüfung der Konformität der PSA mit den anwendbaren grundlegenden Gesundheitsschutz- und Sicherheitsanforderungen und gegebenenfalls zur Ermittlung der jeweiligen Schutzklasse;
- eine Beschreibung der Mittel, mit denen der Hersteller während der Fertigung der PSA deren Konformität mit den Entwurfsspezifikationen sicherstellt;
- ein Exemplar der Anleitung und der Informationen des Herstellers gemäß Anhang II Nummer 1.4;
- bei PSA, die als Einzelstück für einen individuellen Nutzer maßgefertigt werden, alle erforderlichen Anweisungen für die Herstellung solcher PSA auf der Grundlage des zugelassenen Grundmodells;
- bei serienmäßig hergestellten PSA, bei denen jedes Einzelstück an einen individuellen Nutzer angepasst wird, eine Beschreibung der Maßnahmen, die vom Hersteller während des Montage- und des Herstellungsverfahrens zu treffen sind, um sicherzustellen, dass jedes Exemplar der PSA mit dem zugelassenen Baumuster übereinstimmt und die anwendbaren grundlegenden Gesundheitsschutz- und Sicherheitsanforderungen erfüllt.
e) Grundlegende Gesundheitsschutz- und Sicherheitsanforderungen
Eine Persönliche Schutzausrüstung muss die sogenannten „grundlegenden Gesundheitsschutz- und Sicherheitsanforderungen“ erfüllen. Diese Anforderungen spezifiziert der Anhang II der Verordnung. Beispiele für diese Anforderungen sind
- Einhalten von Entwurfsgrundsätzen,
- Sicherstellen von Bequemlichkeit und Effizienz,
- Gewährleistung der Unschädlichkeit,
- Vorhandensein von Anleitungen und Informationen
sowie weitere zusätzliche Anforderungen für die verschiedene Arten von PSA oder bei besonderen Risiken.
Dabei verlangt die PSA-Verordnung (ähnlich die Regularien für Medizinprodukte), den „Stand der Technik“ zu berücksichtigen. Diesen Stand der Technik reflektieren die oben genannten harmonisierten Normen in ihren jeweils aktuellsten Ausgaben.
f) Konformitätsbewertungsverfahren
Dass die persönliche Schutzausrüstung tatsächlich den Anforderungen der PSA-Verordnung genügt, müssen die Hersteller im Rahmen eines Konformitätsbewertungsverfahrens für jedes Produkt nachweisen.
Der Umfang dieses Konformitätsbewertungsverfahrens hängt von der Produktkategorie ab.
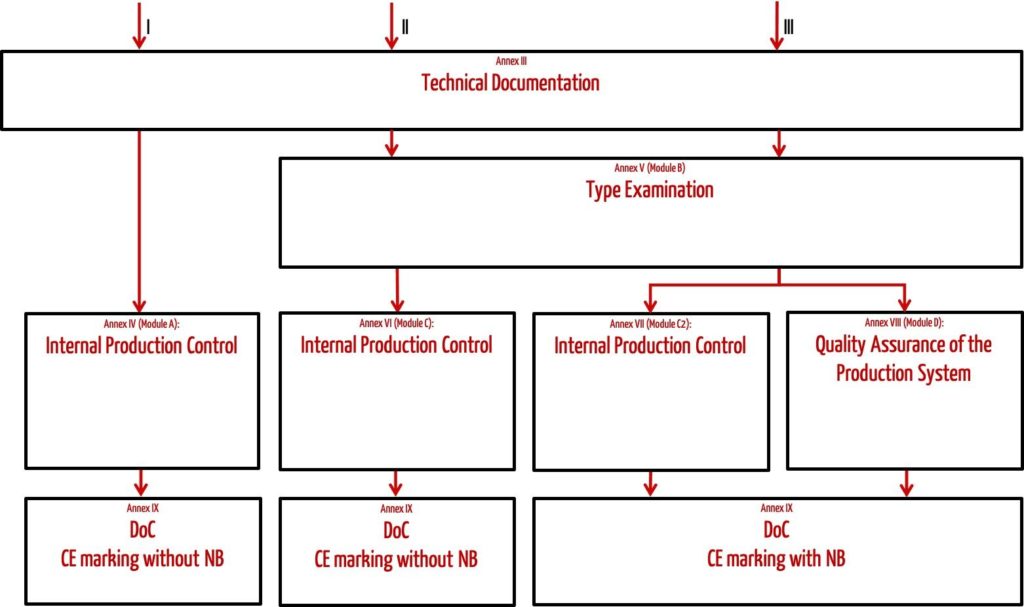
Persönliche Schutzausrüstung aller Kategorien
Zu allen Produkten muss eine produktspezifische technische Dokumentation nach Anhang III erstellt werden.
Persönliche Schutzausrüstung der Kategorie I
Hersteller der Kategorie I müssen zusätzlich eine interne Fertigungskontrolle nach Anhang IV (Modul A) durchführen.
Persönliche Schutzausrüstung der Kategorie II
Produkte der Kategorie II werden einer Baumusterprüfung nach Anhang V (Modul B) durch eine Benannte Stelle unterzogen. Die Benannte Stelle prüft die Baumuster auf Konformität mit den regulatorischen Anforderungen. Durch eine Fertigungskontrolle nach Anhang VI (Modul C) stellt der Hersteller die fortwährende Qualität und Sicherheit seiner Produkte sicher.
Persönliche Schutzausrüstung der Kategorie III
Produkte der Kategorie III können durch zwei verschiedene Wege zur Konformitätserklärung gelangen.
- Möglichkeit: Neben der Baumusterprüfung nach Anhang V (Modul B) wird die Konformität auf Grundlage einer internen Fertigungskontrolle mit überwachten Produktprüfungen in unregelmäßigen Abständen (Anhang VII, Modul C2) nachgewiesen.
- Möglichkeit: Neben der Baumusterprüfung nach Anhang V wird die Konformität auf Grundlage einer Qualitätssicherung bezogen auf den Produktionsprozess (Anhang VIII, Modul D) nachgewiesen.
Bei beiden Wegen muss der Herstelle eine Benannte Stelle einbeziehen und deren Kennnummer neben dem CE-Kennzeichen auf dem Produkt anbringen.
In Deutschland existieren 18 Benannte Stellen für die Verordnung 2016/425. Eine Liste aller Benannten Stellen für diese Verordnung ist auf der Webseite der EU zu finden.
g) Kategorisierung / Klassifizierung
Die Einteilung persönlicher Schutzausrüstung in die Kategorien erfolgt auf Basis von Anhang I der PSA-Verordnung.
Kategorie I umfasst ausschließlich folgende geringfügige Risiken:
- Oberflächliche mechanische Verletzungen
- Kontakt mit schwach aggressiven Reinigungsmitteln oder längerer Kontakt mit Wasser
- Kontakt mit heißen Oberflächen, deren Temperatur 50 °C nicht übersteigt
- Schädigung der Augen durch Sonneneinstrahlung (außer bei Beobachtung der Sonne)
- Witterungsbedingungen, die nicht von extremer Art sind
Kategorie II umfasst Risiken, welche nicht unter Kategorie I oder Kategorie III aufgeführt sind.
Kategorie III umfasst ausschließlich Risiken, welche zu schwerwiegenden Folgen wie Tod oder irreversiblen Gesundheitsschäden im Zusammenhang mit Folgendem führen können:
- Gesundheitsgefährdende Stoffe und Gemische
- Atmosphären mit Sauerstoffmangel
- Schädliche biologische Agenzien
- Ionisierende Strahlung
- Warme Umgebung, die vergleichbare Auswirkungen hat wie eine Umgebung mit einer Lufttemperatur von 100 °C oder mehr
- Kalte Umgebung, die vergleichbare Auswirkungen hat wie eine Umgebung mit einer Lufttemperatur von – 50 °C oder weniger
- Stürze aus der Höhe
- Stromschlag und Arbeit an unter Spannung stehenden Teilen
- Ertrinken
- Schnittverletzungen durch handgeführte Kettensägen
- Hochdruckstrahl
- Verletzungen durch Projektile oder Messerstiche
- Schädlicher Lärm
Ein Handschuh, der bei der Gartenarbeit schützen soll, fällt in die Kategorie I. Ein Handschuh, der einen Metzger vor Messerstichen schützen soll (Kettenhandschuh), muss die Anforderungen der Kategorie III erfüllen.
Wem diese Regeln nicht ausreichen, dem sei der europäische Leitfaden „PPE Regulation (EU) 2016/425 Guidelines“ ans Herz gelegt. Der Leitfaden kommentiert die gesamte PSA-Verordnung verständlich und liefert viele Umsetzungshinweise. Hinweise zur Kategorisierung finden sich auf den Seiten 82 ff.
a) Wie muss ich Schutzkleidung einordnen: als PSA oder als MP?
Die Einordnung des Produktes in die Kategorie persönliche Schutzausrüstung oder Medizinprodukt erfolgt wie oben beschrieben auf Basis der Zweckbestimmung.
Die EU schreibt in einer Empfehlung der Kommission:
„Einweg- und Mehrweg-Gesichtsmasken zum Schutz vor durch Partikel verursachte Gefahren, Einweg- und Mehrweg-Schutzanzüge sowie Handschuhe und Schutzbrillen, die zur Vorbeugung von schädlichen biologischen Agenzien wie Viren und zum Schutz vor diesen verwendet werden, sind Produkte, die in den Anwendungsbereich der Verordnung (EU) 2016/425 fallen. […]
Empfehlung der EU-Kommission
Operationsmasken, Untersuchungshandschuhe und gewisse Arten von Kitteln sind Produkte, die in den Anwendungsbereich der Richtlinie 93/42/EWG und der Verordnung (EU) 2017/745 fallen.“
Nicht-invasive Medizinprodukte (medizinische Handschuhe und weitere medizinische Schutzkleidung) fallen in Klasse I, sofern nicht spezifische Regeln gelten.
grundlegenden Gesundheits- und Sicherheitsanforderungen erfüllen.
c) Wie soll ich vorgehen, um mein Produkt in den Markt zu bringen?
Gehen Sie wie folgt vor, wenn Sie persönliche Schutzausrüstung in Europa auf den Markt bringen wollen:
- Dokumentieren Sie zuerst die Zweckbestimmung des Produkts.
- Qualifikation: Entscheiden Sie dann, ob das Produkt ein Medizinprodukt oder eine persönliche Schutzausrüstung ist.
- Regularien: Identifizieren Sie, basierend auf dieser Entscheidung, welche Verordnung anwendbar ist:
Die MDR oder/und die PSA-Verordnung. - Wählen Sie das Konformitätsbewertungsverfahren aus.
- Entwerfen Sie das Produkt und erstellen Sie die technische Dokumentation im Einklang mit den „grundlegenden Sicherheits- und Leistungsanforderungen“ (MDR) bzw. den „grundlegenden Gesundheits- und Sicherheitsanforderungen“ (PSA-Verordnung). Ziehen Sie zum Nachweis die relevanten (harmonisierten) Normen heran und lassen Sie Ihre Produkte in Prüflaboren testen.
- Bringen Sie Ihr Produkt in Verkehr
3. Unterstützung durch das Johner Institut
a) Medizinprodukte
Das Johner Institut hilft Herstellern dabei, Medizinprodukte schnell und unkompliziert in den Markt zu bringen:
- Regulatorische Strategie festlegen
- Benannte Stellen auswählen
- Labor für Prüfung nach DIN EN 14683 auswählen
- Technische Dokumentation erstellen
- QM-System aufbauen und prüfen
- Biokompatibilität prüfen
- Produkte im Markt überwachen (Post-Market Surveillance)
- u.v.m.
b) Persönliche Schutzausrüstung
Herstellern von persönlicher Schutzausrüstung unterstützt das Johner Institut dabei, die Tests nach EN 149 durchzuführen oder die Biokompatibilität der Produkte nachzuweisen und Firmen zu identifizieren, die bei weiteren Schritten behilflich sein können.
Nehmen Sie gerne Kontakt auf.
4. Fazit, Zusammenfassung
Insbesondere während der Corona-Krise 2020 wurde die Bedeutung von persönlicher Schutzausrüstung (PSA) ins Bewusstsein fast aller Menschen gerückt. Das Johner Institut konnte während dieser Zeit zahlreiche Maskenhersteller bei der Inverkehrbringung sicherer Produkte unterstützen. Selten war die Nutzen-Risiko-Bewertung so wichtig.
Die gesetzlichen Anforderungen, die PSA-Hersteller erfüllen müssen, sind in der EU-Verordnung 2016/425 klar beschrieben. Diese Anforderungen ähneln von der Struktur her den Anforderungen der MDR. Allerdings sind sie weniger umfangreich. Hersteller sollten Normen heranziehen, um die Konformität ihrer PSA-Produkte nachzuweisen. Sie müssen zudem ein Konformitätsbewertungsverfahren durchlaufen, bevor die Produkte in Verkehr gebracht werden dürfen.




Sehr geehrter Herr Koppenhagen,
vielen Dank für diesen umfangreichen und detaillierten Beitrag!
In der aktuellen Situation und als Nachwirkung der besonders angespannten Lage in Bezug auf Atemschutzmasken und Mund-Nasenschutz im medizinischen Umfeld, herrscht weiterhin teilweise große Unsicherheit im Markt. Verstehe ich Absatz 3. b) zum Thema „Ausnahmeregelung“ richtig, dass für Atemschutzmasken und Mund-Nasenschutz grundsätzlich vor Inverkehrbringen das vereinfachte Prüfverfahren und eine Sondergenehmigung des BfArM (für Medizinprodukte) bzw. der zuständigen Marktüberwachungsbehörde (für PSA) durchlaufen bzw. vorliegen muss, sowie diese Produkte nur an medizinisches Fachpersonal für die Dauer der Krise (Definition?) ausgegeben werden dürfen?
Vielleicht eignet sich diese Fragestellung ja sogar für einen weiteren Beitrag…
Besten Dank für Ihre Rückmeldung!
T. Riedel
Sehr geehrter Herr Riedel,
vielen Dank für Ihre positives Feedback!
In der Tat ist das Thema und die aktuelle Lage nach wie vor etwas undurchsichtig.
Im Idealfall werden Medizinprodukte konform mit der MDD bzw. MDR zugelassen.
Bei Schutzausrüstung wäre die PSA-Verordnung die entsprechende Regularie.
So zugelassene Produkte sind mit dem CE-Kennzeichen versehen und können frei in Verkehr gebracht und bereitgestellt werden.
Da ein solches Konformitätsbewertungsverfahren Zeit benötigt, gibt es vorübergehend vereinfachte Prüfmöglichkeiten.
Insbesondere für neue Hersteller oder Importeuere ist dies von Bedeutung.
Medizinprodukte, wie Mund-Nasen-Schutz, können eine Sonderzulassung nach § 11 MPG durch das BfArM erhalten.
Mund-Nasen-Schutzmasken müssen für eine Sonderzulassung mindestens die EN 14683 erfüllen.
Diese Sonderzulassung wird zeitlich beschränkt.
Eine Beschränkung der Abgabe auf medizinisches Fachpersonal könnte geschehen, wird derzeit aber nicht so gehandhabt.
PSA Produkte müssen mindestens die EN 149 oder vergleichbare Standards erfüllen.
Atemschutzmasken, welche in anderen Ländern (s. oben) in Verkehr gebracht wurden, können auch in Europa vorübergehend als verkehrsfähig angesehen werden,
dürfen jedoch ausschließlich an medizinisches Personal abgegeben werden und dürfen nicht in die „normalen“ Vertriebskanäle genlangen.
Atemschutzmasken ohne Ventil können wie MNS vorübergehend nach § 11 MPG von einer Sonderzulassung profitieren.
Es gibt für PSA auch einen vereinfachten Prüfgrundsatz.
So geprüfte Produkte können als „Corona Pandemie Atemschutzmaske“ (CPA) in Verkehr gebracht werden – nicht jedoch als PSA.
Die Produkte dürfen nicht als PSA oder FFP-Masken gekennzeichnet sein.
Übrigens:
Heute wurde ein neuer Prüfgrundsatz der ZLS veröffentlicht.
Den Blogbeitrag werden wir entsprechend anpassen und den Link mit aufnehmen.
Ich hoffe, ich konnte Ihnen weiter helfen.
Falls nicht, dürfen Sie gerne nachhaken!
Beste Grüße,
Philipp Koppenhagen
Sehr geehrter Herr Koppenhagen,
besten Dank für die zusätzlichen Erläuterungen und den Hinweis auf den aktualisierten Prüfgrundsatz.
Zum Thema PSA hätte ich aber tatsächlich noch eine Nachfrage. Von der Verkehrsfähigkeit von PSA für med. Fachpersonal kann vorübergehend ausgegangen werden, sofern die Atemschutzmasken in den USA, Kanada, Australien oder Japan verkehrsfähig wären, und zwar ohne vorherige vereinfachte Prüfung lt. ZLS und Genehmigung einer Marktüberwachungsbehörde.
Für Atemschutzmasken aus China gilt dies aber nicht, oder? Hier wäre demnach zwingend der Weg über die vereinfachte Prüfung und behördliche Genehmigung zu beschreiten, um diese Masken dann als CPA in Verkehr bringen zu können.
Viele Grüße
Thorsten Riedel
Sehr geehrte Damen und Herren,
vielen Dank für diese in vielen Teilen sehr hilfreichen Artikel.
Eine Frage bleibt: Kann ich einen unsterilen, wiederaufbereitbaren OP Mantel als PSA Mantel auf einer Intensivstation z.B. verwenden?
ich finde leider keine schlüssige Antwort mit den Normen DIN 13795 & DIN 14126
Mfg
RR
Sehr geehrter Herr Reichenberger,
vielen Dank für Ihre spannende Frage!
Die verschiedenen Normen, wie die DIN 13795 oder die DIN 14126, stellen lediglich die Anforderungen an die Produkte selbst.
Die Auswahl eines Produktes ist situationsspezifisch und hängt insbesondere von der konkreten Tätigkeit und den Anforderungen dieser Tätigkeit ab, denen das Produkt genügen muss.
So legt die EN 13795 die Anforderungen für Abdecktücher und -mäntel für chirurgische Eingriffe fest.
Für den Eigenschutz vor übertragbaren Infektionskrankheiten sollten EN 14126 zertifizierte Produkte den EN 13795 zertifizierten Produkten vorgezogen werden.
Allerdings lässt sich Ihre Frage nicht pauschal beantworten.
Weitere Faktoren sind das Kontaminationsrisiko, das Risiko einer Durchfeuchtung des Produktes, oder auch die Verfügbarkeit der Produkte.
Sie können für eine Abschätzung die KRINKO-Empfehlungen heranzuziehen, insbesondere die Empfehlung für
„Infektionsprävention im Rahmen der Pflege und Behandlung von Patienten mit übertragbaren Krankheiten“.
Weiter müssen natürlich die Vorgaben der medizinischen Einrichtung beachtet werden.
Ich hoffe, dass ich Ihnen etwas weiter helfen konnte und wünsche Ihnen ein erholsames Wochenende.
Mit besten Grüßen
Philipp Koppenhagen
Sehr geehrter Herr Koppenhagen,
die Information zur Abgrenzung von PSA und Medizinprodukt fand ich sehr interessant. Abseits von Covid-19 habe ich dazu eine Frage: falls ein Produkt die Kriterien für PSA und Medizinprodukt erfüllt, muss es dann auch für beides zertifiziert werden oder kann es nur als PSA verkauft werden? Konkret geht es um normale Lärmschutzstöpsel für den Privatgebrauch.
Über ein kurze Antwort würde ich mich freuen.
Herzliche Grüße
Ursula Schüller
Sehr geehrte Frau Schüller,
vielen Dank für Ihre spannende Frage, auf welche ich gerne eingehe.
Sie sollten die Zweckbestimmung des Produktes heranziehen und prüfen, welche Regularien anzuwenden sind.
In Ihrem konkreten Fall dürfte das Produkt der Verhütung von Verletzungen im Ohr und damit im weiteren Sinne als Schutz gegen ein Risiko für die Gesundheit dienen.
Damit würde das Produkt unter die Definition einer PSA fallen (vgl. Artikel 3, PSA-VO), allerdings nicht unter die Definition eines Medizinprodukts (vgl. Artikel 2, MDR).
Falls ein Produkt auf Basis der Zweckbestimmung jedoch unter die Begriffsdefinition einer persönlichen Schutzausrüstung und eines Medizinproduktes fällt, so müssen beide Verordnungen eingehalten werden.
Falls ich Ihre Frage nicht abschließend beantworten konnte, haken Sie gerne nach!
Viele Grüße aus Konstanz
Philipp Koppenhagen
Sehr geehrter Herr Koppenhagen,
vielen Dank für die schnelle Antwort. Allerdings frage ich mich, ob Lärmschutzstöpsel nicht doch auch Medizinprodukte sind, denn sie sollen ja Gehörschäden verhindern, was der Definition eine Medizinproduktes (u.a. Verhütung von Krankheiten) entspricht. Oder interpretiere ich das falsch?
Vielen Dank und freundliche Grüße
Ursula Schüller
Sehr geehrte Frau Schüller,
Einen Gehörschaden durch Lärm würde ich als eine „Verletzung“ ansehen.
Unter die Definition eines Medizinprodukts fallen aber eben keine Produkte, die der Vorbeugung von Verletzungen dienen. Ansonsten wäre beispielsweise auch ein Fahrradhelm nicht nur eine PSA, sondern auch ein Medizinprodukt. Produkte, die als Zweck die Behandlung von Verletzungen haben, sind allerdings Medizinprodukte.
Diese Feinheiten sind nicht immer einfach zu entdecken, haben aber große Auswirkungen.
Daher ist eine exakt formulierte Zweckbestimmung auch so wichtig.
Mit besten Grüßen
Philipp Koppenhagen
Hallo Herr Koppenhagen,
vielen Dank auch für diese Antwort, die mir sehr weitergeholfen hat.
Ich möchte Sie nicht überstrapazieren, hätte aber noch eine letzte Spezialfrage zum Thema Ohrstöpsel: welchen Status hat Ihrer Meinung nach ein Ohrstöpsel, der Wasser im Ohr aufsaugt (nach dem Schwimmen oder Tauchen)? Dadurch wird der Gehörgang getrocknet, was u.a. das Risiko einer Ohrentzündung senkt. Der amerikanische Hersteller sagt, dass es sich dabei weder um eine PSA, noch um ein Medizinprodukt handelt, ich hätte aber vermutet, dass trotzdem eine CE-Kennzeichnung nötig ist.
Vielen Dank und Grüße
Ursula Schüller
Guten Tag Frau Schüller,
die Frage kann ich ohne weitere Informationen leider nur unzureichend beantworten.
Melden Sie sich doch gerne über unser Kontaktformular, wenn Sie eine genaue Einschätzung wünschen.
Mit besten Grüßen zum Wochenende
Philipp Koppenhagen
Sehr geehrter Herr Koppenhagen
Braucht es für ein PSA Produkt ein EU Bevollmächtigten, falls der Hersteller ausserhalb des EWR ist?
Dies wird in der Verordnung EU 2016/425 PSA nicht klar definiert.
Vielen Dank für Ihre Rückmeldung
Freundliche Grüsse Seline Güggi
Sehr geehrte Frau Güggi,
vielen Dank für Ihre Frage!
Ich empfehle Ihnen den „Blue Guide on the implementation of EU product rules„.
Im Punkt 3.2 wird dies erläutert.
Bei Medizinprodukten und IVDs ist ein Authorised Representative Pflicht, wenn der Hersteller außerhalb des EWR sitzt.
Konnte ich Ihre Frage beantworten?
Mit besten Grüßen
Philipp Koppenhagen
Hallo,
Ich habe eine Rückfrage zur d) Technische Dokumentation.
Wenn man PSA aus einem Drittland importiert und der Hersteller bereits eine Technische Dokumentation hat.
Darf man diese nutzen oder muss diese in Deutscher Sprache sein?
Und wenn Sie in Deutsch sein muss wäre es möglich die bereits vorhandenen Dokumentation einfach zu übersetzen?
Guten Tag,
die Technische Dokumentation kann beispielsweise auch in Englisch vorgehalten werden, wenn dies auch die benannte Stelle akzeptiert (abhängig von der Produktklasse).
Die Gebrauchsanweisung muss zumeist in Amtssprache verfasst sein. Die Anforderungen hierzu finden Sie in der entsprechenden Verordnung und Normen.
In der PSA-VO wäre dies Kapitel I, Artikel 8, 10 und 11.
Beachten Sie ggf. weitere Voraussetzungen bei einem Import aus einem Drittland (Stichwort EU-Repräsentant).
Viele Grüße aus Konstanz
Philipp Koppenhagen